近日,山东大学脑与类脑科学研究院王剑教授团队与挪威卑尔根大学、山东大学兼职讲席教授Rolf Bjerkvig,在神经肿瘤学顶级期刊《Neuro-Oncology》(中科院一区TOP,IF: 16.4)上发表了题为“Development of a highly differentiated rat brain organoid model for exploring glioblastoma invasion dynamics and therapy”的研究论文。山东第一医科大学附属省立医院的周文婧主治医师、卢森堡健康研究所的Elena Martinez-Garcia博士及哈佛大学博士后Katharina Sarnow博士为该论文的共同第一作者,王剑教授和Rolf Bjerkvig教授为共同通讯作者。
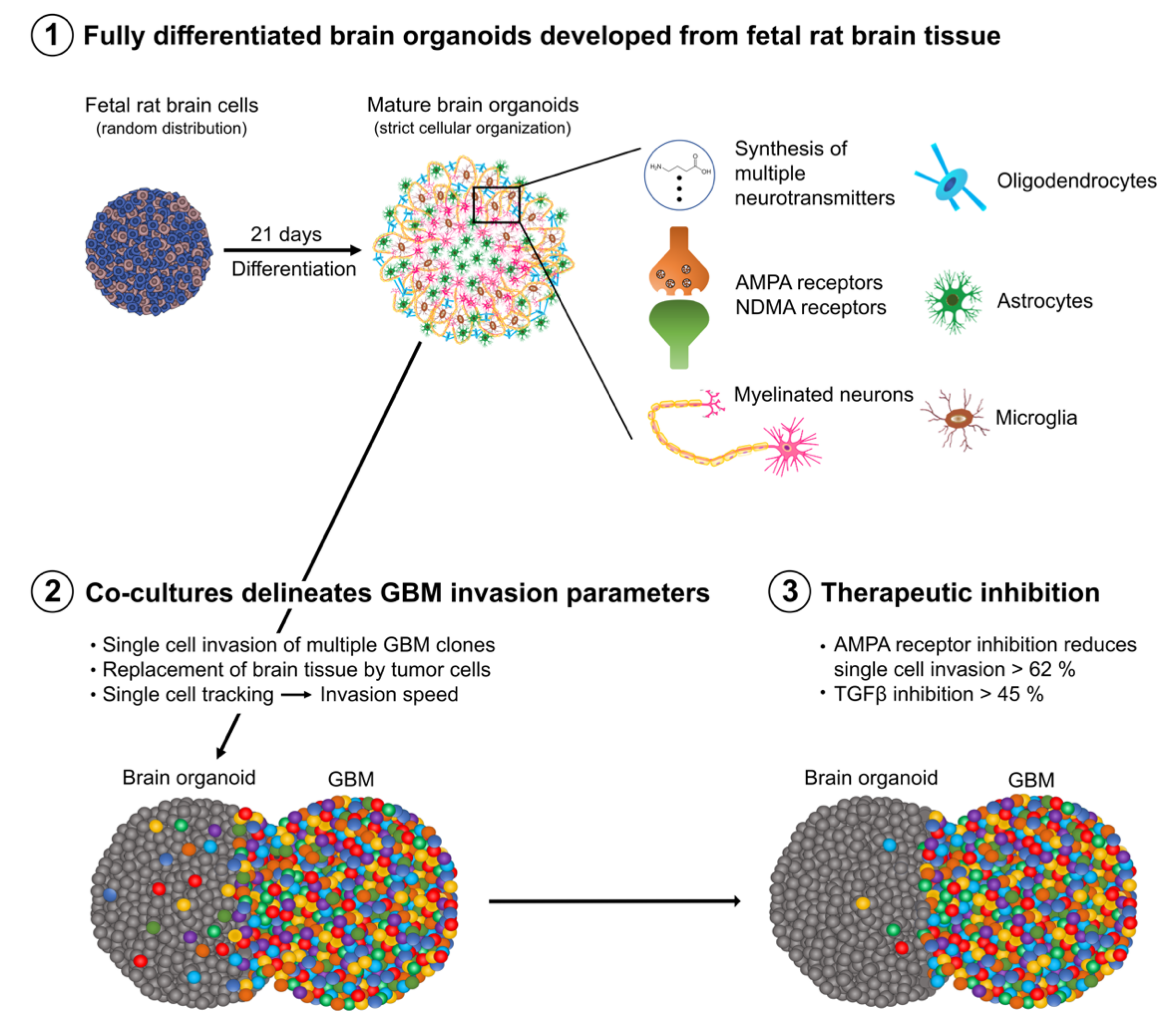
团队针对现有类脑器官模型(尤其是人多能干细胞iPSC来源的类脑器官)难以达到终末分化、无法完全模拟成熟大脑微环境的关键瓶颈,创新性地开发了源自大鼠胚胎脑组织的高度分化类脑器官模型。通过21天的体外培养,该模型成功形成了包含髓鞘化神经元、少突胶质细胞、星形胶质细胞、小胶质细胞及功能性突触的复杂有序结构,在细胞组成、分子表达谱及神经递质合成能力上均高度模拟了大鼠大脑的成熟状态。
研究团队利用该模型,与五种不同侵袭特性的人源胶质瘤干细胞共培养,实现了对胶质瘤侵袭行为的实时、动态和量化分析,精准复刻了其在活体大脑中的生长特性。更重要的是,团队首次通过单细胞测序等技术证明,成熟的类脑器官微环境能主动“重编程”肿瘤细胞,诱导其代谢转向糖酵解并增强侵袭能力,这一过程部分由类脑器官释放的细胞外囊泡介导。此外,研究还成功利用该平台评估了TGFβ抑制剂及AMPA受体拮抗剂(Perampanel)等不同作用机制的药物对肿瘤侵袭的抑制效果,验证了其作为高通量药物筛选平台的潜力。
该类脑器官模和人大脑生理相关性强,可高通量、高重复性、低费用构建,不仅克服了现有模型的局限性,为深入探究胶质瘤侵袭机制提供了强大工具,也为快速评估抗侵袭新疗法、推动神经肿瘤学精准治疗研究开辟了新路径。
该项目得到了国家自然科学基金、国家“111”引智计划、泰山学者专项基金以及挪威癌症研究会的支持。
原文信息:
Zhou W#, Martinez-Garcia E#, Sarnow K#, Kanli G, Nazarov PV, Li Y, Schwab S, Meiser J, Jaeger C, Mieczkowski J, Misztak A, Thorsen FA, Grützmann K, Mihaljevic B, van Loon B, Hossain JA, Zhang Y, Xue Z, Li W, Moreino SS, Golebiewska A, Niclou SP, Bj➢rås M, Tardito S, Joseph JV, Lunavat TR, Saed HS, Bahador M, Han M, Fabian C, Miletic H, Li X, Dittmar G, Keunen O#, Klink B#, Wang J, Bjerkvig R#. Development of a highly differentiated rat brain organoid model for exploring glioblastoma invasion dynamics and therapy. Neuro Oncol. 2025. doi: 10.1093/neuonc/noaf271. PMID: 41284925.
原文链接:https://pubmed.ncbi.nlm.nih.gov/41284925/